La diabetes tipo 1 es una enfermedad autoinmune caracterizada por la pérdida progresiva de células beta pancreáticas. Golimumab es un anticuerpo monoclonal humano específico para el factor de necrosis tumoral α que ya ha sido aprobado para el tratamiento de varias enfermedades autoinmunes en adultos y niños. Se desconoce si golimumab podría preservar la función de las células beta en jóvenes con diabetes tipo 1 manifiesta (etapa 3) recién diagnosticada.
 En este ensayo de fase 2, multicéntrico, controlado con placebo, doble ciego, de grupos paralelos, se asignaron aleatoriamente, en una proporción de 2:1, a niños y adultos jóvenes (rango de edad, 6 a 21 años) con diabetes tipo 1 manifiesta recién diagnosticada para recibir golimumab subcutáneo o placebo durante 52 semanas. La variable principal fue la producción de insulina endógena, evaluada de acuerdo con el área bajo la curva de concentración-tiempo para el nivel de péptido C en respuesta a una prueba de tolerancia a las comidas mixtas de 4 horas (AUC del péptido C de 4 horas) en la semana 52. Las variables secundarias y adicionales incluyeron el uso de insulina, el nivel de hemoglobina glicosilada, el número de eventos hipoglucémicos, la proporción de proinsulina a péptido C en ayunas a lo largo del tiempo y el perfil de respuesta.
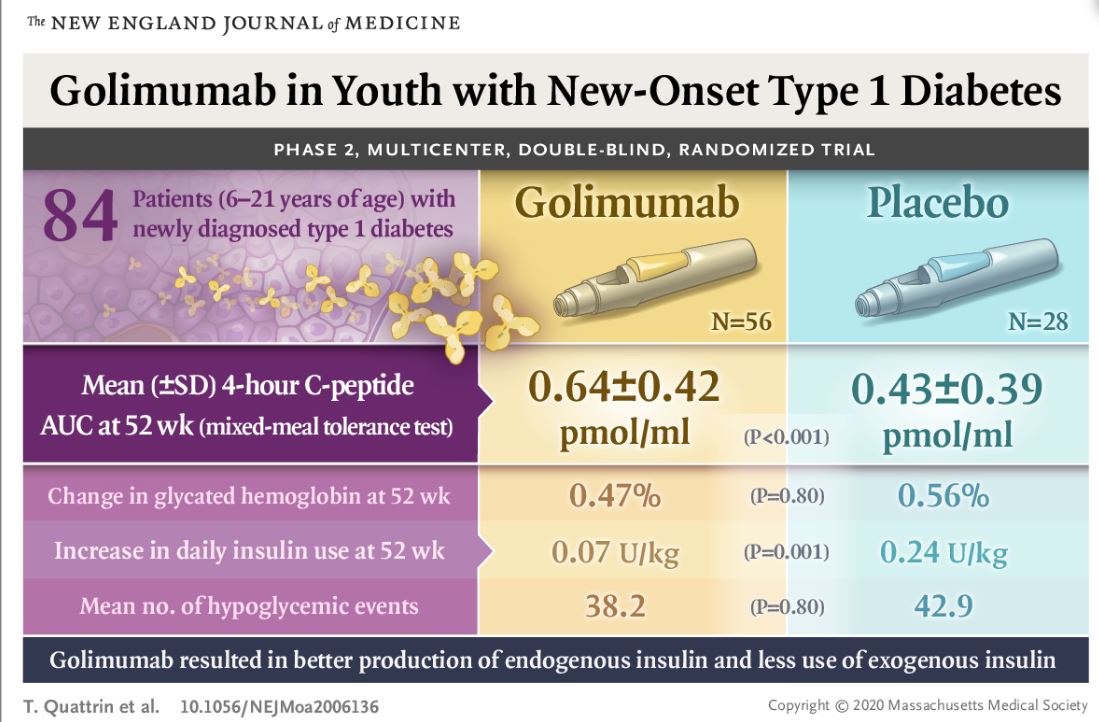
En este ensayo de fase 2, multicéntrico, controlado con placebo, doble ciego, de grupos paralelos, se asignaron aleatoriamente, en una proporción de 2:1, a niños y adultos jóvenes (rango de edad, 6 a 21 años) con diabetes tipo 1 manifiesta recién diagnosticada para recibir golimumab subcutáneo o placebo durante 52 semanas. La variable principal fue la producción de insulina endógena, evaluada de acuerdo con el área bajo la curva de concentración-tiempo para el nivel de péptido C en respuesta a una prueba de tolerancia a las comidas mixtas de 4 horas (AUC del péptido C de 4 horas) en la semana 52. Las variables secundarias y adicionales incluyeron el uso de insulina, el nivel de hemoglobina glicosilada, el número de eventos hipoglucémicos, la proporción de proinsulina a péptido C en ayunas a lo largo del tiempo y el perfil de respuesta.
Un total de 84 participantes se sometieron a asignación al azar: 56 fueron asignados al grupo de golimumab y 28 al grupo de placebo. La media (± SD) del AUC del péptido C a las 4 horas en la semana 52 difirió significativamente entre el grupo de golimumab y el grupo de placebo (0,64±0,42 pmol por mililitro frente a 0,43±0,39 pmol por mililitro, p<0,001). Un enfoque de tratamiento a objetivo condujo a un buen control glucémico en ambos grupos y no hubo diferencias significativas entre los grupos en el nivel de hemoglobina glicosilada. El uso de insulina fue menor con golimumab que con placebo. Se observó una respuesta de remisión parcial (definida como una puntuación del nivel de hemoglobina glicosilada ajustada a la dosis de insulina [calculada como el nivel de hemoglobina glicosilada más 4 veces la dosis de insulina] de ≤9) en el 43% de los participantes del grupo de golimumab y en el 7% de los del grupo placebo (diferencia, 36 puntos porcentuales; IC del 95%, 22 a 55). El número medio de eventos hipoglucémicos no difirió entre los grupos de ensayo. Los eventos hipoglucémicos que se registraron como eventos adversos a discreción de los investigadores se informaron en 13 participantes (23%) en el grupo de golimumab y en 2 (7%) de los del grupo de placebo. Se detectaron anticuerpos contra golimumab en 30 participantes que recibieron el fármaco; 29 tenían títulos de anticuerpos inferiores a 1:1000, de los cuales 12 tenían resultados positivos para anticuerpos neutralizantes.
Entre los niños y adultos jóvenes con diabetes tipo 1 manifiesta de diagnóstico reciente, el golimumab resultó en una mejor producción de insulina endógena y un menor uso de insulina exógena que el placebo.
Javier López Ávila
Urgencias de Pediatría. Hospital Universitario de Salamanca